Nevyslyšená poselství u leukemie
Když před šesti lety hodnotil Jean Bernard 150 let zkoumání leukemie a snahy o její léčení, shrnul, že jde o historii úsilí proti ignoranci a dogmatům. Zní to tvrdě od člověka, jenž r. 1934 prokázal souvislost mezi vznikem leukemie a vznikem jiných zhoubných nádorů (experimentálně navodil leukemii injekcemi asfaltu, který obsahuje rakovinotvorné látky). Vzpomíná, že mu ještě r. 1935 jeden prominentní hematolog řekl: Zajisté nejste tak naivní, abyste věřil, že leukemie a rakovina spolu souvisejí! Klíč k zvládnutí této choroby není jen v poznání genetických mutací a změn leukemické buňky, ale i ve vztazích leukemických buněk k ostatním buňkám a k mimobuněčné hmotě.
Věnujme se proto především úloze dřeňového prostředí při vzniku leukemie, i když to není jediný mechanizmus, který se na vzniku této choroby podílí. Tento pohled přinesl zajímavé poznatky a zdá se, že stojíme před perspektivní oblastí bádání. Podobné mechanizmy interakcí mimobuněčné hmoty a buněk se neuplatňují jen při krvetvorbě, ale také v jiných tkáních či orgánech.
Trest za nesmrtelnost
Zcela odlišně se v kostní dřeni chovají buňky, které pozměnila leukemická transformace. Leukemie je zhoubné (maligní) onemocnění. Dřeňové buňky, z nichž u zdravého jedince vznikají bílé krvinky, se při leukemii nekontrolovatelně množí (někdy rychleji, někdy pomaleji než buňky normální krvetvorby). Leukemické buňky mají poškozený genom, v tom je základní příčina poruchy (obdobná jiným zhoubným onemocněním). Mívají různé vady diferenciačního programu a často se podobají časným stadiím krvetvorných buněk, mohou však opouštět kostní dřeň. Program buněčné smrti v nich bývá zablokován, a proto žijí déle nebo se mohou dělit. Jejich počet v krvi pak může dosahovat obrovských hodnot. Leukemické buňky nejsou vyzrálé morfologicky ani funkčně, neplní úlohu krvinek. Některé formy leukemií vedou k smrti během krátké doby – několika týdnů. Za nesmrtelnost leukemických buněk tak platí smrtí celý organizmus.
Leukemické buňky nejsou vyzrálé morfologicky ani funkčně, neplní úlohu krvinek. Některé formy leukemií vedou k smrti během krátké doby – několika týdnů. Za nesmrtelnost leukemických buněk tak platí smrtí celý organizmus.
Buněční a nebuněční dozorci
Proč normální krvetvorné buňky nemohou z kostní dřeně vycestovat, zatímco nezralé leukemické buňky mohou? Tvorbu krvinek reguluje mnoho látek, souborně označovaných jako cytokiny. Na regulaci krvetvorby se významnou měrou podílí také mikroprostředí kostní dřeně, které umožňuje růst a diferenciaci krvetvorných buněk. Tvoří je buňky stromatu a mimobuněčná hmota, kterou tyto buňky vylučují.Stroma obsahuje zejména fibroblasty, makrofágy, buňky tukové, retikulární, endotelové a hladkého svalstva. Buňky stromatu produkují některé cytokiny (Vesmír 71, 511, 1992/9) a některé cytokiny produkují i samy krvetvorné buňky a zralé lymfocyty. Část buněk stromatu je v kontaktu s krvetvornými buňkami, a zřejmě na ně působí prostřednictvím mezibuněčných komunikací.
Mimobuněčná hmota (extracelulární matrix) tvoří prostorové sítě vzniklé propojením makromolekul (viz Vesmír 70, 425, 1991/8) a má zásadní úlohu v rozčlenění kostní dřeně. Obsahuje zejména kolagen, fibronektin, proteoglykany, tenascin, trombospondin, laminin a hemonektin – vesměs látky, které se vyskytují i v jiných tkáních.
Proč leukemické buňky přežívají cytotoxickou léčbu
Látky, které ničí buňky, označujeme jako cytotoxické. Cytotoxicita vůči leukemickým buňkám je základem farmak používaných při léčbě. Část leukemických buněk však dokáže přežít i velmi vysoké dávky cytotoxických léků. Proč?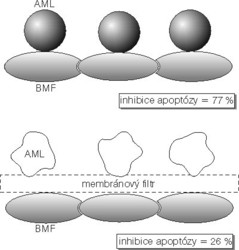 Buňky akutní myeloidní leukemie (AML, vyskytuje se především u dospělých osob) a akutní lymfoblastické leukemie (ALL, hlavně u dětí a starších dospělých) se rovněž vážou na buňky stromatu a mimobuněčnou hmotu. Jejich dělení je častější, jestliže mají možnost kontaktu s buňkami stromatu. Buňky myelomu zvyšují svoji odolnost proti lékům zvyšením počtu receptorů typu integrinu α4β1 a jejich vazbou na fibronektin. Ochrana, kterou stroma a mimobuněčná hmota dřeně leukemickým buňkám poskytují, se zdá být jednou z příčin, proč jich část přežívá i intenzivní cytotoxickou chemoterapii.
Buňky akutní myeloidní leukemie (AML, vyskytuje se především u dospělých osob) a akutní lymfoblastické leukemie (ALL, hlavně u dětí a starších dospělých) se rovněž vážou na buňky stromatu a mimobuněčnou hmotu. Jejich dělení je častější, jestliže mají možnost kontaktu s buňkami stromatu. Buňky myelomu zvyšují svoji odolnost proti lékům zvyšením počtu receptorů typu integrinu α4β1 a jejich vazbou na fibronektin. Ochrana, kterou stroma a mimobuněčná hmota dřeně leukemickým buňkám poskytují, se zdá být jednou z příčin, proč jich část přežívá i intenzivní cytotoxickou chemoterapii.
Poselství mimobuněčné hmoty
Vztahy mezi buňkami a mimobuněčnou hmotou vytvářejí důležité regulační mechanizmy. Jejich studium se bouřlivě vyvíjí, přibývá prací, v nichž se řeší vztah normálních krvetvorných a leukemických buněk k mimobuněčné hmotě (právě na jejích vlastnostech je přežití leukemických buněk závislé). Počet důkazů, že přežití leukemických buněk a jejich růst závisí na vlastnostech mimobuněčné hmoty, vzrůstá. Tyto vztahy jsou významné i pro studium leukemií a možností jejich léčby.- Nejčastější leukemií je chronická myeloidní leukemie (CML), viz článek R. Brdičky (Vesmír 78, 506, 1999/9). Buňky chronické myeloidní leukemie mají sníženou schopnost adheze k buňkám stromatu. Tento defekt je vyvolán chybou v integrinové podjednotce β1. Uvedené postižení lze potlačit podáním interferonu a, k vyléčení to ovšem nevede. Vliv cytokinů na adhezi buněk k mimobuněčné hmotě dřeně je ale důležitý pro transplantace.
- Buňky CML mají také nižší adhezivitu k fibronektinu, zatímco jejich adheze ke kolagenu IV a lamininu je vyšší. Dosud není jasné, zda by se tyto vlastnosti nedaly využít k léčbě.
- Pro normální krvetvorné buňky představuje kontakt s buňkami stromatu a dřeňovou mimobuněčnou hmotou informaci, jež potlačuje uvolnění nezralých buněk do krve. Leukemické buňky, které mají poruchy genomu, a tudíž i své struktury a metabolizmu, tomuto poselství nerozumějí.
Hledání možností
Krvetvorné buňky mají pro složky mimobuněčné hmoty receptory, jimiž přenášejí do nitrobuněčného prostoru informace o charakteru této hmoty. Mnoho se o tom však neví. Mimobuněčná hmota má také vliv na dostupnost cytokinů, které do ní buňky stromatu vyloučily. Přímé kontakty s buňkami stromatu a vliv cytokinů mohou někdy vyvolat apoptickou smrt jak normálních, tak leukemických buněk, jindy naopak některé části dřeňového mikroprostředí leukemické buňky před apoptózou chrání.
Mimobuněčná hmota má také vliv na dostupnost cytokinů, které do ní buňky stromatu vyloučily. Přímé kontakty s buňkami stromatu a vliv cytokinů mohou někdy vyvolat apoptickou smrt jak normálních, tak leukemických buněk, jindy naopak některé části dřeňového mikroprostředí leukemické buňky před apoptózou chrání.
Např. přidání fibronektinu, který je běžnou součástí mimobuněčné hmoty v kostní dřeni, může vyvolat apoptózu myeloidních buněk (vznikají z nich bílé krvinky). Tato apoptóza je zprostředkována integrinem α5β1 vyskytujícího se v plazmatické membráně myeloidních buněk. Takto se apoptózou snižuje počet nadbytečných krvetvorných buněk u zdravého člověka.
Hledání možností, jak podobnou „přirozenou“ cestou záměrně vyvolat i apoptózu leukemických buněk, je nepochybně lákavé. Není to však jediný směr. V každém případě hraje mimobuněčná hmota v řízení krvetvorby důležitou roli – reguluje buněčnou adhezi.
Program života včetně smrti
Krvetvorba probíhá u dospělých lidí především v kostní dřeni. Z krvetvorných buněk v ní opakovaným dělením a zráním vznikají krvinky. Ty opouštějí kostní dřeň a uvolňují se do krve. Některé v krvi už zůstanou (červené krvinky a destičky), jiné (bílé krvinky) plní své poslání v různých tkáních.
Krvinky se již nedělí, nesou v sobě program smrti a po určité době zanikají (lidským červeným krvinkám to trvá 110–120 dní). Tento program se spouští v okamžiku, kdy pramáti krvinek – multipotentní kmenová krvetvorná buňka – dává při buněčném dělení vzniknout diferencovanější dceřiné buňce – unipotentní kmenové a progenitorové. Tyto buňky sice mají ještě jistou schopnost sebeobnovy, ale počínající diferenciace již zpečeťuje nejen jejich osud, ale i osud následných generací buněk: po splnění funkčních povinností čeká zralé krvinky buněčná smrt. (Programovaná buněčná smrt s charakteristickými morfologickými a biochemickými znaky se nazývá apoptóza; Vesmír 73, 550, 1994/10.)
Po všechna dělení a v průběhu zrání zůstávají krvetvorné buňky v kostní dřeni – tu opouštějí až zralé krvinky. Jen předchůdci T-lymfocytů dokončují zrání v brzlíku, nicméně i z něj se do krve dostávají zralé formy. Jen nepatrná část krvetvorných buněk se uvolní do krve.
Receptory
Receptory, které s mimobuněčnou hmotou interagují, jsou umístěny v plazmatické membráně krvetvorných buněk. Bývají různého typu: integriny, kadheriny (Vesmír 75, 133, 1996/3), selektiny, imunoglobuliny, syndekany a několik adhezivních receptorů, které dosud nebyly klasifikovány. Nejvíce se zkoumají (nejen ve vztahu ke krvetvorbě) receptory z rodiny integrinů.
Cesty smrti
Důležitou vlastností, jíž se leukemické buňky zřetelně liší od normálních krvetvorných buněk, je schopnost jejich migrace uvnitř dřeně i mimo ni. Uvnitř dřeně mohou leukemické buňky vyhledávat místa, která jsou nejvhodnější pro jejich růst. Normální krvetvorné buňky nemigrují, a tak si leukemické buňky mohou na rozdíl od nich vybírat ta nejlepší vazebná místa ve stromatu. Schopnost migrovat leukemickým buňkám umožní, aby vycestovaly mimobuněčnou hmotou, mezi buňkami stromatu, přes bazální membránu a sinusoidové endotelie do krve. Později bloudí i jinými tkáněmi.
Na putování leukemických buněk se podílejí některé bílkoviny jejich plazmatické membrány. Například u akutní lymfoblastové leukemie to jsou transmembránové integriny typu β1. Jestliže se tyto integriny zablokují, leukemické buňky schopnost migrace ztrácejí. Adheze buněk AML a ALL s buňkami stromatu a mimobuněčnou hmotou kostní dřeně vyžaduje především účast integrinů obsahujících řetězec β1, méně pak i řetězec β2. Specifické interakce krvetvorných buněk jsou v leukemických buňkách zčásti pozměněny. Proto nejsou nezralé leukemické buňky zadržovány v kostní dřeni, ale ve velkém množství se vyplavují do krve. Mechanizmus změn specifických adhezivních reakcí však dosud plně poznán nebyl.
INTEGRINY
se skládají ze dvou podjednotek, jedna je označována α, druhá β. Je popsáno patnáct různých řetězců α a přinejmenším sedm řetězců β. Větší či menší specifičnost integrinových receptorů závisí na jejich složení. Obsahují-li podjednotky typu β1 a β3, zúčastňují se hlavně interakcí buněk s mimobuněčnou hmotou. Obsahují-li řetězce β2, podílejí se výlučně na mezibuněčných interakcích. Například integrin α1β1 je receptorem pro kolageny typu I, IV, VI a laminin, integrin α5β1 pro fibronektin.
Ke stažení
 Článek ve formátu PDF [190,3 kB]
Článek ve formátu PDF [190,3 kB]











